三次元マイクロピラー構造を用いた電極の高感度化


 研究目的
研究目的
ガラス基板上に直径10、20及び30 µm の微小ピラーを500 x 500 µmの範囲に形成し作用極とした。この基板上にマイクロ流路を形成したポリジメチルシロキ酸(PDMS)基板を貼り合わせ、フローシステムを形成した。
アスコルビン酸溶液を送液して応答電流を測定した結果、直径 10 µm ピラー電極では、平面電極に比べ12.9倍の高感度化が達成された。さらに、作用極表面に金黒と呼ばれる多孔質構造を形成させ、表面積の大幅な増大による感度の向上を検討した。その結果、直径30 µmピラー電極において、20倍まで感度が向上することが示された。
応用として、骨代謝マーカータンパクである骨型アルカリフォスターゼ(BAP)の検出を、電気化学的ELISAにより行った。結果、平面電極に比べ最大で6倍の応答電流値が得られた(Fig. 3)。これらの結果から、マイクロピラー構造が標的タンパクの検出に有効であることが示された。この技術は、様々なマーカータンパクを迅速かつ簡便に検出するデバイスへと応用が可能である。


 研究内容
研究内容
システムの基本的な構造を図1に示す。本デバイスは、電極、ポジティブレジスト絶縁膜、PDMSによる流路からなる。電極は一電極作用極(Pt)、参照極(Ag/AgCl)、対極(Pt)のパターンを作製し、一電極作用極は高効率な検出対象物質の酸化のために上部にくし型電極を持つ。ポジティブレジスト絶縁膜は電極に沿ってパターンされており、一電極作用極上にピンホールを作る役割も持つ。PDMS流路は液絡で繋がれた2本からなり、片方の流路ではくし型電極上において検出対象物質の酸化、もう一方ではピンホール電極上において金属の析出が自発的に進行する。 また、上部の流路は微量溶液を計量できるように設計されている。ピンホール電極上に濃縮されて析出した金属は迅速に溶解するため、バックグラウンド増大前に測定を終了することが可能である(図2)。本研究では、析出させる金属を変更してp-アミノフェノール(PAP)と過酸化水素の測定を行った。その結果、析出させる金属を銀から銅とニッケルに変更することで、測定値に差が生じた(図3)。このことから、析出金属変更によって、選択的な検出が可能であることがわかった。

Fig. 1 (a)-(c)マイクロピラー電極 (d)金黒電極表面
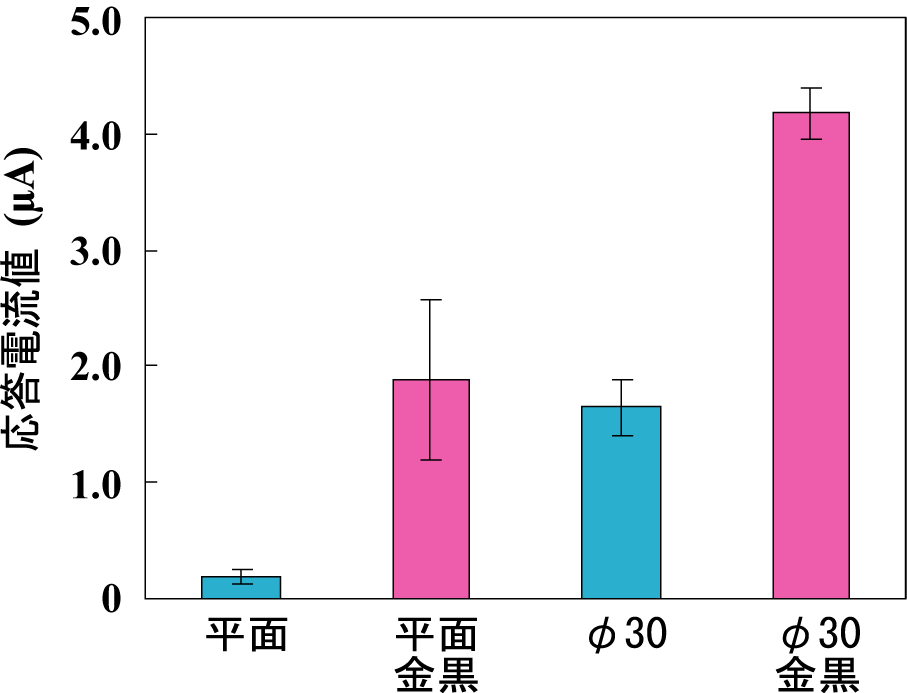
Fig. 2 アスコルビン酸の検出
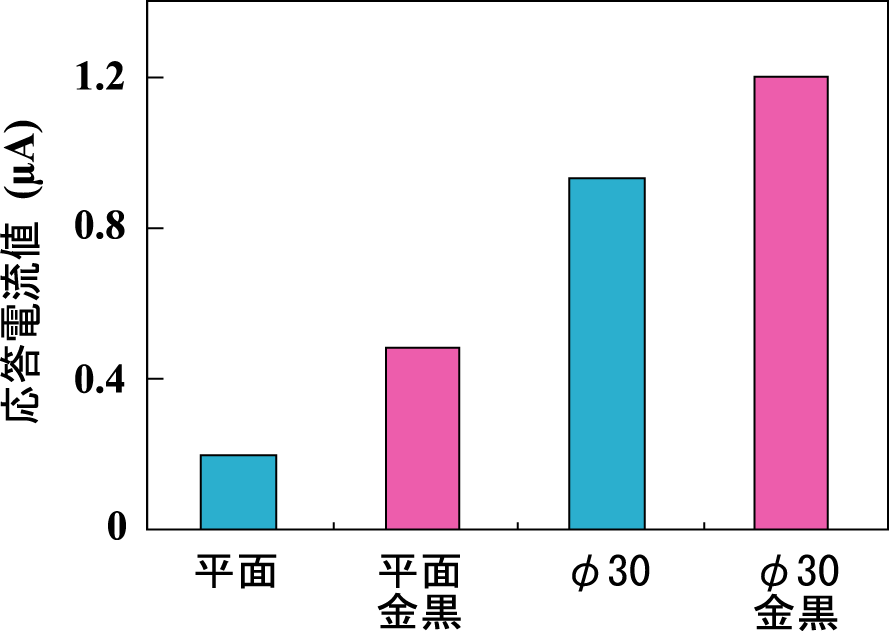
Fig. 3 BAPの検出


